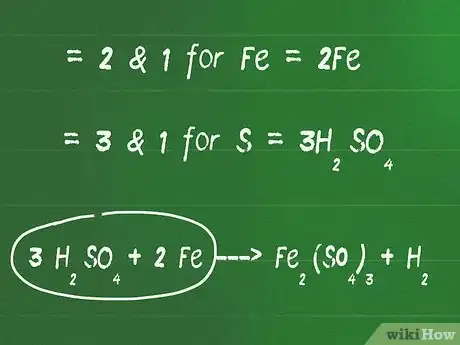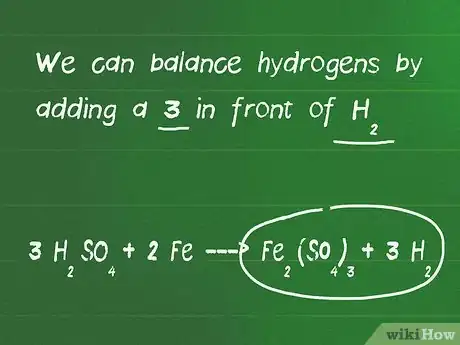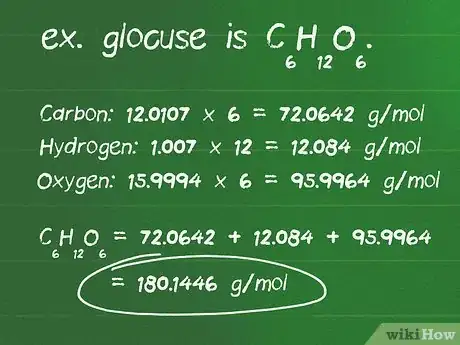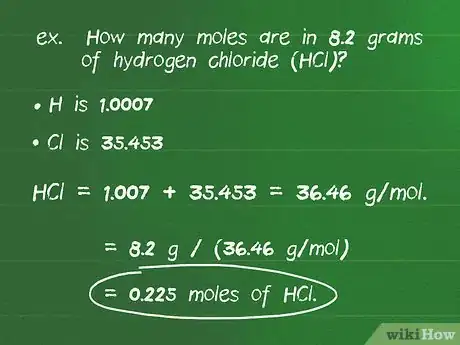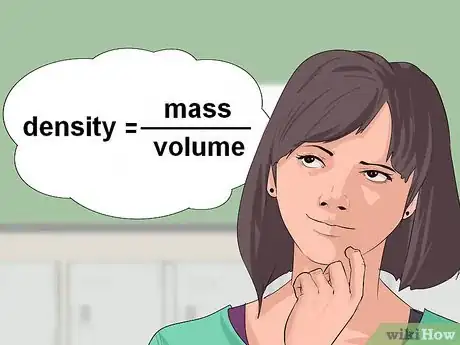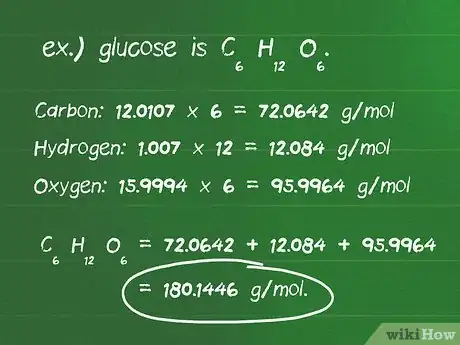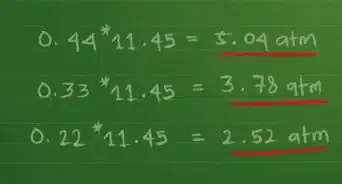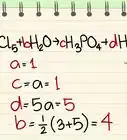Este artículo fue coescrito por Bess Ruff, MA. Bess Ruff es estudiante de doctorado en Geografía en la niversidad de Florida State. Recibió su maestría en Ciencias y Gestión Ambiental en la Universidad de California, Santa Bárbara en 2016. Ha realizado trabajos de encuestas para proyectos de planificación de espacio marino en el Caribe y ha brindado apoyo de investigación como becaria de posgrado del Sustainable Fisheries Group.
En este artículo, hay 11 referencias citadas, que se pueden ver en la parte inferior de la página.
Este artículo ha sido visto 77 724 veces.
En una ecuación química, la materia no puede crearse ni destruirse, por lo que los productos que salen de una reacción deben ser iguales a los reactivos que entran en ella. La estequiometría es la medida de los elementos dentro de una reacción.[1] Involucra cálculos que toman en cuenta las masas de los reactivos y productos en una reacción química dada. La estequiometría es mitad matemática y mitad química y gira en torno al principio simple mencionado anteriormente: el principio de que la materia nunca se pierde ni se gana durante una reacción. El primer paso para resolver cualquier problema de química es balancear la ecuación.
Pasos
Parte 1
Parte 1 de 4:Balancear la ecuación química
-
1Anota el número de átomos que conforman cada compuesto a cada lado de la ecuación. Usando la ecuación química, puedes identificar los átomos de cada elemento en la reacción. Debido a que una reacción química nunca puede crear ni destruir materia nueva, una ecuación dada no está balanceada si el número (y los tipos) de átomos a cada lado de la ecuación no encajan perfectamente.
- No olvides multiplicar por un coeficiente o subíndice si hay uno presente.
- Por ejemplo, H2SO4 + Fe ---> Fe2(SO4)3 + H2
- Del lado de los reactivos (el izquierdo) de la ecuación, hay 2 H, 1 S, 4 O y 1 Fe.
- Del lado del producto (el derecho) de la ecuación, hay 2H, 3 S, 12 O y 2 Fe.
-
2Agrega un coeficiente frente a los elementos que no sean oxígeno e hidrógeno para balancear cada lado. Identifica el mínimo factor común entre todos los elementos que no sean oxígeno e hidrógeno para obtener números iguales de átomos a ambos lados.
- Por ejemplo, el mínimo factor común entre 2 y 1 es 2 para Fe. Agrega un 2 frente a Fe del lado izquierdo para balancearlo.
- El mínimo factor común entre 3 y 1 es 3 para S. Agrega un 3 frente a H2SO4 para balancear los lados izquierdo y derecho.
- En esta etapa, nuestra ecuación se ve así: 3 H2SO4 + 2 Fe ---> Fe2(SO4)3 + H2.
-
3Balancea los átomos de hidrógeno y oxígeno. Los átomos de hidrógeno y oxígeno se balancean al final porque aparecen comúnmente en múltiples moléculas a cada lado de la ecuación. En esta etapa del proceso de balancear la ecuación, no olvides volver a contar los átomos si has agregado coeficientes y moléculas.
- En nuestro ejemplo, agregamos un 3 frente a H2SO4 y ahora tenemos 6 hidrógenos a la izquierda y solo 2 a la derecha de la ecuación. También tenemos 12 oxígenos a la izquierda y 12 oxígenos a la derecha, así que están balanceados.
- Podemos balancear los hidrógenos agregando un 3 frente a H2.
- Nuestra ecuación final balanceada es 3 H2SO4 + 2 Fe ---> Fe2(SO4)3 + 3 H2.
-
4Vuelve a contar el número de átomos a cada lado de la ecuación para asegurarte de que sean iguales. Una vez que hayas terminado, es sensato regresar y revisar la ecuación para ver si está balanceada. Esto puede hacerse sumando nuevamente todos los átomos a cada lado de la ecuación para asegurarte de que sean iguales a ambos lados.
- Revisemos nuestra ecuación, 3 H2SO4 + 2 Fe ---> Fe2(SO4)3 + 3 H2, para ver si está balanceada.
- Del lado izquierdo de la flecha, hay 6 H, 3 S, 12 O y 2 Fe.
- Del lado derecho de la flecha, hay 2 Fe, 3 S, 12 O y 6 H.
- Los lados izquierdo y derecho de la ecuación son iguales; por lo tanto, la ecuación está balanceada.
Anuncio
Parte 2
Parte 2 de 4:Convertir entre gramos y moles
-
1Calcula la masa molar del compuesto dada en gramos. La masa molar es la cantidad en gramos (g) de un mol de un compuesto.[2] Te permite convertir fácilmente entre los gramos y moles de una sustancia.[3] Para calcular la masa molar, tienes que identificar cuántas moléculas de un elemento hay en el compuesto y la masa atómica de cada elemento en el compuesto.
- Define el número de átomos de cada elemento de un compuesto. Por ejemplo, la glucosa es C6H12O6. Hay 6 átomos de carbono, 12 átomos de hidrógeno y 6 átomos de oxígeno.
- Identifica la masa atómica en gramos por mol (g/mol) de cada átomo. Las masas atómicas de los elementos en la glucosa son: carbono, 12,0107 g/mol; hidrógeno, 1,007 g/mol; y oxígeno, 15,9994 g/mol.
- Multiplica la masa atómica de cada elemento por el número de átomos presentes en el compuesto. Carbono: 12,0107 x 6 = 72,0642 g/mol; hidrógeno: 1,007 x 12 = 12,084 g/mol; oxígeno: 15,9994 x 6 = 95,9964 g/mol.
- Sumar estos productos produce la masa molar del compuesto. 72,0642 + 12,084 + 95,9964 = 180,1446 g/mol. 180,14 gramos es la masa de un mol de glucosa.
-
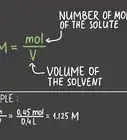
2Convierte gramos de una sustancia a moles usando la masa molar. Usando la masa molar como un factor de conversión, puedes calcular el número de moles presentes en el número dado de gramos de la especie. Divide la cantidad conocida de gramos (g) entre la masa molar (g/mol).[4] [5] Una forma fácil de revisar que hayas hecho el cálculo correcto es asegurarte de que las unidades se cancelen dejando solamente moles.
- Por ejemplo: ¿cuántos moles hay en 8,2 gramos de cloruro de hidrógeno (HCl)?
- La masa atómica de H es 1,0007 y la de Cl es 35,453, por lo que la masa molar del compuesto es 1,007 + 35,453 = 36,46 g/mol.
- Dividir el número de gramos de la sustancia entre la masa molar da como resultado: 8,2 g / (36,46 g/mol) = 0,225 moles de HCl.
-
3Determina la proporción molar entre los reactivos. A fin de determinar el rendimiento de un producto en una reacción dada, tienes que determinar la proporción molar. La proporción molar te dice la proporción en la que las sustancias reaccionan unas con otras y se da por el coeficiente de las especies en la reacción balanceada.[6]
- Por ejemplo, ¿cuál es la proporción molar de KClO3 a O2 en la reacción 2 KClO3 ---> 2 KCl + 3 O2.
- Primero, revisa para ver si la ecuación está balanceada. Nunca olvides este paso o tus proporciones estarán equivocadas. En este caso, hay cantidades iguales de cada elemento a ambos lados de la reacción, así que está balanceada.
- La proporción de KClO3 a O2 es 2/3. No importa cuál número vaya en la parte superior y la inferior con tal que mantengas los mismos compuestos en la parte superior y la inferior a lo largo del resto del problema.[7]
-
4Haz una regla de tres con la proporción molar para encontrar los moles de otros reactivos. Para calcular el número de moles de una especie producida o requerida para una reacción, usarás la proporción molar.[8] Los problemas generalmente te pedirán que determines el número de moles requerido o el número de moles producido en una reacción dado un determinado número de gramos de reactivo.
- Por ejemplo, dada la reacción N2 + 3 H2 ---> 2 NH3, ¿cuántos moles de NH3 se producirán dados 3,00 gramos de N2 que reaccionen con suficiente H2?
- En este ejemplo, suficiente H2 significa que hay suficiente disponible y no tienes que tomarlo en cuenta para resolver el problema.
- Primero, convierte los gramos de N2 a moles. La masa atómica del nitrógeno es 14,0067 g/mol, así que la masa molar de N2 es 28,0134 g/mol. Dividir la masa entre la masa molar te da 3,00 g/28,0134 g/mol = 0,107 mol.
- Establece las proporciones dadas en la ecuación: NH3:N2 = x/0,107 mol.
- Haz una regla de tres con esta proporción y la proporción molar de NH3 a N2, la cual es 2:1. x/0,107 mol = 2/1 = (2 x 0,107) = 1x = 0,214 mol.
-
5Convierte moles a masa usando la masa molar de la especie. Usarás la masa molar otra vez pero esta vez multiplicarás para convertir los moles de regreso a gramos. Asegúrate de usar la masa molar de la especie correcta.
- La masa molar de NH3 es 17,028 g/mol. Por lo tanto, 0,214 mol x (17,028 g/mol) = 3,647 gramos de NH3.
Anuncio
Parte 3
Parte 3 de 4:Convertir entre litros de gas y moles
-
1Determina si la reacción sucede a presión y temperatura normales (PTN). PTN es el conjunto de condiciones dadas en donde 1 mol de un gas ideal ocupa 22,414 litros (L) de volumen.[9] La temperatura estándar es 273,15 Kelvin (K) y la presión estándar es 1 atmósfera (atm).[10]
- Generalmente, una reacción dirá que se produce a 1 atm y 273 K o simplemente dirá PTN.
-
2Usa el factor de conversión 22,414 L/mol para convertir litros de gas a moles. Si la reacción sucede a PTN, puedes usar 22,414 L/mol para calcular el número de moles en un determinado volumen de gas.[11] Divide el volumen de gas (L) entre el factor de conversión para determinar los moles.
- Por ejemplo, convierte 3,2 litros de gas N2 a moles: 3,2 L/22,414 L/mol = 0,143 moles.
-
3Usa la ley de los gases ideales para convertir litros de gas que no estén a PTN. Si se te da una reacción que no ocurre a PTN, tendrás que usar la ley de los gases ideales PV = nRT para determinar el número de moles en la reacción.[12] P es la presión en atmósferas, V es el volumen en litros, n es el número de moles, R es la constante de los gases ideales 0,0821L-atm/mol-K y T es la temperatura en grados Kelvin.[13]
- La ecuación puede reorganizarse para encontrar el número de moles: n = RT/PV.
- Las unidades de la constante de los gases ideales están diseñadas para cancelar las unidades de las demás variables.
- Por ejemplo, determina el número de moles en 2,4 litros de O2 a 300 K y 1,5 atm. Reemplazar las variables da como resultado: n = (0,0821 x 300)/(1,5 x 2) = 24,63/3,6 = 6,842 moles de O2.
Anuncio
Parte 4
Parte 4 de 4:Convertir entre litros de líquido y moles
-
1Calcula la densidad del líquido. A veces, las ecuaciones químicas te darán el volumen de un reactivo líquido y requerirán la cantidad de gramos o moles necesarios para la reacción. Para convertir a gramos, usarás la densidad de ese líquido. La densidad se obtiene por la masa dividida entre el volumen.
- Si no se te da la densidad en el problema, es posible que tengas que buscarla en un texto de referencia o en línea.
-
2Convierte el volumen a mililitros (ml). Para convertir el volumen de líquido a masa (g), tendrás que usar la densidad de ese líquido. La densidad se da en gramos por mililitro (g/ml). Por lo tanto, el volumen del líquido tiene que estar en mililitros para convertirlo.
- Identifica el volumen dado. Por ejemplo, digamos que el problema dice que tienes 1 litro de H2O. Para convertir a ml, simplemente multiplica por 1.000. Hay 1.000 mililitros en un litro de agua.
-
3Multiplica el volumen por la densidad. Cuando multiplicas el volumen (ml) de un líquido por la densidad de ese líquido (g/ml), los mililitros se cancelan y te quedas con los gramos de la sustancia.[14]
- Por ejemplo, la densidad de H2O es 18,0134 g/ml. Si la ecuación química dice que tienes 500 ml de H2O, entonces la cantidad de gramos es 500 ml x 18,0134 g/ml = 9006,7 g.
-
4Calcula la masa molar del reactivo. La masa molar es la cantidad en gramos (g) de un mol de un compuesto. Te permite convertir fácilmente entre gramos y moléculas de una sustancia. Para calcular la masa molar, tienes que identificar cuántas moléculas de un elemento hay en un compuesto y la masa atómica de cada elemento en el compuesto.
- Define el número de átomos de cada elemento en un compuesto. Por ejemplo, la glucosa es C6H12O6. Hay 6 átomos de carbono, 12 átomos de hidrógeno y 6 átomos de oxígeno.
- Identifica la masa atómica en gramos por mol (g/mol) de cada átomo. Las masas atómicas de los elementos en la glucosa son: carbono, 12,0107 g/mol; hidrógeno, 1,007 g/mol; y oxígeno, 15,9994 g/mol.
- Multiplica la masa atómica de cada elemento por el número de átomos presente en el compuesto. Carbono: 12,0107 x 6 = 72,0642 g/mol; hidrógeno: 1,007 x 12 = 12,084 g/mol; oxígeno: 15,9994 x 6 = 95,9964 g/mol.
- Sumar estos productos produce la masa molar del compuesto. 72,0642 + 12,084 + 95,9964 = 180,1446 g/mol. 180,14 gramos es la masa de un mol de glucosa.
-
5Convierte los gramos de una sustancia a moles usando la masa molar. Usando la masa molar como un factor de conversión, puedes calcular el número de moles presente en el número dado de gramos de la especie. Divide la cantidad conocida de gramos (g) entre la masa molar (g/mol).[15] [16] Una forma fácil de revisar que hayas hecho el cálculo correcto es asegurarte de que las unidades se cancelen dejando solamente moles.
- Por ejemplo: ¿cuántos moles hay en 8,2 gramos de cloruro de hidrógeno (HCl)?
- La masa atómica de H es 1,0007 y la de Cl es 35,453, por lo que la masa molar del compuesto es 1,007 + 35,453 = 36,46 g/mol.
- Dividir el número de gramos de la sustancia entre la masa molar da como resultado: 8,2 g / (36,46 g/mol) = 0,225 moles de HCl.
Anuncio
Referencias
- ↑ http://www.chemteam.info/Stoichiometry/What-is-Stoichiometry.html
- ↑ http://preparatorychemistry.com/Bishop_molar_mass_conversion_factors_help.htm
- ↑ http://www.chemteam.info/Stoichiometry/Mole-Mass.html
- ↑ http://www.chemteam.info/Stoichiometry/Mass-Mass.html
- ↑ https://www.khanacademy.org/science/chemistry/chemical-reactions-stoichiome/stoichiometry-ideal/a/stoichiometry
- ↑ http://www.chemteam.info/Stoichiometry/Molar-Ratio.html
- ↑ http://www.chemteam.info/Stoichiometry/Mole-Mole.html
- ↑ http://www.chemteam.info/Stoichiometry/Mole-Mole.html
- ↑ http://chemistry-reference.com/stoichiometry/
- ↑ http://www.engineeringtoolbox.com/stp-standard-ntp-normal-air-d_772.html
- ↑ http://www.thegeoexchange.org/chemistry/stoichiometry/liters-to-moles.html
- ↑ http://chemistry-reference.com/stoichiometry/
- ↑ http://www.chemtutor.com/mols.htm
- ↑ http://www.chemtutor.com/mols.htm
- ↑ http://www.chemteam.info/Stoichiometry/Mass-Mass.html
- ↑ https://www.khanacademy.org/science/chemistry/chemical-reactions-stoichiome/stoichiometry-ideal/a/stoichiometry